 |
| Mikroinjeksi |
Pada artikel sebelumnya, Mengenal teknik-teknik dalam rekayasa genetika, telah dibahas berbagai macam teknik-teknik utama dalam rekayasa genetika. Salah satu teknik tersebut adalah bagaimana peneliti memungkinkan gen ditransfer secara efektif ke dalam sel. Pada dasarnya, teknik-teknik yang akan dibahas pada artikel ini, biasa digunakan untuk transfer gen ke dalam sel hewan.mikrobia maupun sel tanaman. Khusus untuk transfer gen pada tanaman dapat anda baca pada artikel Teknologi Tanaman Transgenik.
Suatu gen hasil isolasi dapat ditranskripsi secara in-vitro dan mRNAnya juga dapat ditranslasikan pada suatu sistem bebas sel. Teknik ini memungkinkan peneliti memperoleh sejumlah protein dalam jumlah kecil, yang mungkin tidak cukup untuk beberapa penelitian biokimia, atau untuk penentuan aktifitas biologi protein tersebut secara in vivo atau menentukan strukturnya melalui proses kristalisasi.
Untuk disandikan secara efektif dan ditranslasikan menjadi protein, suatu gen harus ditransfer ke dalam sel, yang secara alami mungkin mengandung semua faktor-faktor yang diper.lkan dalam proses transkripsi dan translasi.
Membran plasma pada berbagai jenis sel yang berbeda merupakan barier yang memungkinkan pengambilan senyawa secara selektif. Pada beberapa kasus, molekul masuk ke dalam sel melalui pori-pori yang terbuka dan tertutuo melalui suatu kontrol oleh sel. Senyawa-senyawa pembawa khusus juga dapat metranspor molekul-molekul untuk kemudian ditransfer ke dalam sel. Pada kasus yang lain, molekul mengenali reseptor-reseptor khusus di bagian luar membran plasma dan membentuk kompleks yang memodifikasi membran secara lokal, yang mengarhkan internalisasi kompleks serta membran yang mengelilinginya, Proses ini disebut endositosis.
DNA merupakan molekul bermuatan negatif dan berukuran besar. DNA tidak bisa melintasi membran plasma secara spontan. Mekanisme ini merupakan cara sel untuk melindungi diri dari DNA asing yang mungkin ada di sekitarnya, Oligonukleotida yang ditambahkan ke medium kultur sek atau diinjeksikan ke dalam hewan dapat memasuki sel pada kondisi dimana mereka ada dalam konsentrasi tinggi,
Membran plasma pada berbagai jenis sel yang berbeda merupakan barier yang memungkinkan pengambilan senyawa secara selektif. Pada beberapa kasus, molekul masuk ke dalam sel melalui pori-pori yang terbuka dan tertutuo melalui suatu kontrol oleh sel. Senyawa-senyawa pembawa khusus juga dapat metranspor molekul-molekul untuk kemudian ditransfer ke dalam sel. Pada kasus yang lain, molekul mengenali reseptor-reseptor khusus di bagian luar membran plasma dan membentuk kompleks yang memodifikasi membran secara lokal, yang mengarhkan internalisasi kompleks serta membran yang mengelilinginya, Proses ini disebut endositosis.
DNA merupakan molekul bermuatan negatif dan berukuran besar. DNA tidak bisa melintasi membran plasma secara spontan. Mekanisme ini merupakan cara sel untuk melindungi diri dari DNA asing yang mungkin ada di sekitarnya, Oligonukleotida yang ditambahkan ke medium kultur sek atau diinjeksikan ke dalam hewan dapat memasuki sel pada kondisi dimana mereka ada dalam konsentrasi tinggi,
Ada berbagai teknik yang bisa digunakan untuk proses transfer gen, diantaranya: 1). Fusi sel; 2). Penggunaan senyawa kimia; 3). Elektroporasi; 4). Injeksi menggunakan vektor virus; 5) Mikroinjeksi.
A. Fusi sel
Sebuah plasmid dapat ditransfer dengan menggabungkan protoplas bakteri dengan sel yang akan ditransfeksikan. Metode ini sebenarnya tidak efesien dan jarang digunakan. Kekurangan lainnya adalah semua gen bakteri juga ikut ditransfer ke dalam sel.
Karena, penggabungan DNA secara in-vitro dengan berbagai molekul yang membentuk suatu kompleks yang memasuki sel bersifat efesien maka teknik ini paling umum digunakan, Salah satu molekul yang biasa digunakan adalah kalsium klorida. Gugus fosfat DNA terikat ke kalsium menghasilkan suatu kompleks tidak larut, yang berpresipitasi jika kelebihan kalsium dan fosfat ditambahkan ke DNA. Campuran tersebut ditambahkan ke dalam medium kultur. Sejumlah kecil compleks tidak laurt yang melingkupi sel kemudian di endositosis secara spontan. DNA kemudian dilarutkan ulang di dalam sitoplasma sel. Sebagian besar DNA yang masuk didegradasi dan sisanyabisa mencapai nukleus, dimana DNA tersebut kemudian ditranskripsi.
 |
| Metode fisik |
C. Elektroporasi
Metode ini dilakukan dengan menaruh sel ke medan listrik arus bolak balik. Hal ini menyebabkan pori sementara di dalam membran plasma. DNA yang ditambahakan pada medium elektroporasi dapat masuk ke dalam sel melalui pori. Medan listrik juga menginduksi mobilitas DNA dan memungkinkan pengambilannya oleh sel. Metode ini sedikit efesien dan biasanya digunakan dengan jenis sel dimana penggunaan senyawa kimia kurang bisa dihandalkan, Sejumlah sel dihancurkan karena pengaruh medan elektrik tersebut, Sehingga teknik ini merupakan metode yang baik untuk menghasilkan klon dengan DNA yang benar-benar terintegrasi. Elektroporasi dalam teknik terbaik untuk transfer gen ke dalam sel punca embrionik (embrionic stem cell) dan menempatkan suatu gen endogen melalui rekombinasi homolog.
 |
| Transfer gen dengan elektroporasi |
D. Infeksi dengan vektor virus
Berbagai vektor virus digunakan untuk mentrasfer gen ke dalam sel. Beberapa gen esensial dihapus dari genom virus. Delesi ini menghasilkan genom virus mampu atau tidak mampu ber replikasi secara otomatis. Hal ini juga membuat ruang di dalam genom virus untuk kemudian disisipkan gen asing. Genom hasil rekombinasi ini sudah tidak mampu menghasilkan partikel virus fungsional, karena protein virus yang esensial sudah hilang. Genom virus hasil rekombinasi tersebut harus ditransfer ke dalam sel yang kemudian diekspresikan secara sementara atau secara stabil. Sel hasil transformasi ini kemudian mampu mensintesis partikel virus yang mengandung gen asing.
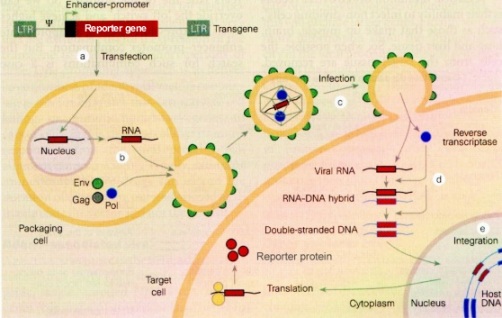 |
| Transfer gen dengan vektor virus |
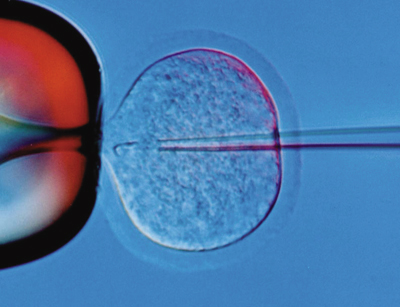
E. Mikroinjeksi
DNA di dalam larutan dpat dimikroinjeksikan secara langsung ke dalam sitoplasma sel atau nukleus. Teknik ini sulit dan membutuhkan persyaratan khusus (mikroskop dan mikroinjektro) dan latihan khusus.
 |
| Teknik transfer gen dengan mikroinjeksi |
Artikel ini sebagian besar disarikan dari Houdebine, LM. 2003. Animal Transgenesis and Cloning. Wiley England.